VAT na wyroby medyczne
Kody UDI w placówce medycznej
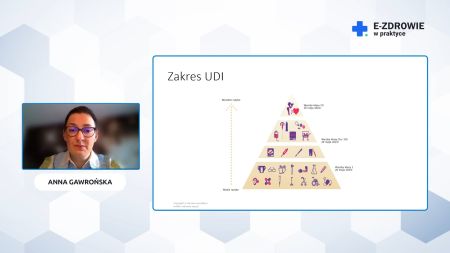
Zapraszamy do obejrzenia webinaru poświęconego systemowi identyfikacji wyrobów medycznych – UDI. Ma on na celu zapewnienie przejrzystości łańcucha dostaw od producenta, aż do użytkownika końcowego, jakim jest pacjent. W przypadku wystąpienia wady danego produktu medycznego, możliwe będzie bardzo szybkie zidentyfikowanie pacjentów, którym został podany. Wdrażanie kodów UDI podzielone zostało na 3 etapy.
System UDI dotyczy wyrobów medycznych, a jego celem jest stworzenie mechanizmu niepowtarzalnej identyfikacji wyrobów medycznych w skali całego świata.
W przeszłości zdarzało się, że po określonym okresie użytkowania danego wyrobu medycznego np. implantu, okazywało się, że jest on wadliwy. Istniała więc potrzeba zidentyfikowania wszystkich pacjentów, którym wszczepiono taki implant.
Jednak dane o wprowadzonych na rynek wyrobach medycznych przechowywane były w postaci papierowej i to w zakresie danego przedsiębiorstwa, które wyprodukowało dany wyrób medyczny. Brakowało więc standardów w zakresie niepowtarzalnej identyfikacji wyrobów medycznych. Właśnie w tym celu wprowadzono kody UDI.
Kody UDI zostały określone w unijnym rozporządzeniu 2017/745 z 5 kwietnia 2017 r. w sprawie wyrobów medycznych (Medical Device Regulation tzw. MDR). Na grunt polskich przepisów przeniosła je ustawa o wyrobach medycznych.
Głównym celem stworzenia takiego mechanizmu była poprawa bezpieczeństwa pacjenta i zwiększenie transparentności łańcucha dostaw.
Kody UDI składają się z 3 filarów:
- Identyfikatora wyrobu medycznego – w części: statycznej i dynamicznej,
- bazy danych o wyrobach medycznych wprowadzanych do obrotu – w UE nosi nazwę Eudamed,
- nośnika odczytywanego maszynowo - kodu kreskowego.
Wiodąca organizacją wydającą kody UDI jest GS1 z której standardów korzystają wytwórcy z polski oraz całego świata.
Wymogi w zakresie kodów UDI zostały podzielone na 3 transze w zależności od klasy ryzyka:
- 26 maja 2021 r. – wyroby medyczne klasy III,
- 26 maja 2023 r. - klasy II a i II b,
- 26 maja 2026 r. – klasy I.
Terminy te dotyczą nowowprowadzanych na rynek wyrobów medycznych.
Z webinaru dowiesz się:
- Jakie są korzyści ze stosowania kodów UDI?
- Ile pomyłek powstaje w związku z dostawami wyrobów medycznych?
- Jakie są obowiązki podmiotów medycznych w związku z wdrożeniem kodów UDI?
Obejrzyj także:
- Obowiązki placówek medycznych związane z kodami UDI
- Jak zarządzać przepływem wyrobów medycznych w szpitalu?
- Jakie są korzyści z rachunku kosztów?
Webinar prowadzi: dr Anna Gawrońska